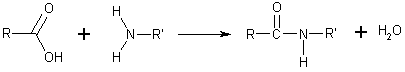La Química Orgánica o Química del carbono es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono ocarbono-hidrógeno y otros heteroátomos, también conocidos como compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.(http://es.wikipedia.org/wiki/Qu%C3%ADmica_org%C3%A1nica)
En la química orgánica se encuentran
AMINAS
AMIDAS
NITRILOS
AMINAS
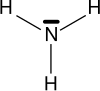
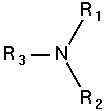
| Amoníaco | Amina primaria | Amina secundaria | Amina terciaria |
|---|---|---|---|
 |  |  |  |
NOMENCLATURA
| Compuesto | Nombres |
|---|---|
| CH3-NH2 | Metilamina o aminometano. |
| CH3-NH-CH3 | Dimetilamina o metilaminometano. |
| CH3-CH2-NH-CH2-CH2-CH3 | Etilpropilamina o etilaminopropano. |
| CH3 | N-CH3 | CH3 | Trimetilamina o dimetilaminometano. |
| CH3 | N-CH2-CH2-CH3 | CH2-CH3 | Etilmetilpropilamina o metiletilaminopropano. N-etil,N-metilpropanoamina |
Propiedades de las Aminas
Las aminas son compuestos orgánicos derivados del amoniaco (NH3), y son producto de la sustitución de los hidrógenos que componen al amoniaco por grupos alquilo o arilo.
Las aminas se clasifican de acuerdo al número de sustituyentes unidos al nitrógeno en aminas primarias, aminas secundarias y terciarias.
Propiedades Físicas
Las aminas son parte de los alcaloides que son compuestos complejos que se encuentran en las plantas. Algunos de ellos son la morfina y la nicotina. Algunas aminas son biológicamente importantes como la adrenalina y la noradrenalina.
Las aminas secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco.
Estas aminas pueden reaccionar con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes, originando N-nitrosoaminas secundarias, que son carcinógenas.http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedaes_aminas.htm
IMPORTANCIA Y USOS
Propiedades Físicas
http://www.juntadeandalucia.es/averroes/recursos_informaticos/concurso1998/accesit8/cad.htm
Los nitrilos son compuestos orgánicos que poseen un grupo ciano (-C≡N) como grupo funcional principal. Son derivados orgánicos del cianuro de los que el hidrógeno ha sido sustituido por un radical alquilo.
NOMENCLATURA
Propiedades Físicas
El grupo ciano está polarizado de tal forma que el átomo de carbono es el extremo positivo del dipolo y el nitrógeno el negativo. Esta polaridad hace que los nitrilos estén muy asociados en estado líquido. Así, sus puntos de ebullición son algo superiores a los de los alcoholes de masa molecular comparable. Los nitrilos de más de 15 carbonos son sólidos.11 Exceptuando los primeros de la serie, son sustancias insolubles en agua. La mayoría de los nitrilos tienen un olor que recuerda al del cianuro de hidrógeno y son moderadamente tóxicos.http://es.wikipedia.org/wiki/Nitrilo
http://www.slideshare.net/iZhiTaa/nitrilos-1866766#
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoníaco. A medida que aumenta el número de átomos de carbono en la molécula, el olor se hace similar al del pescado. Las aminas aromáticas son muy tóxicas se absorben a través de la piel.
| ||||||||||||||||||||||||||||||||||||||
Propiedades químicas
Las aminas se comportan como bases. Cuando una amina se disuelve en agua, acepta un protón formando un ión alquil-amonio |
| Producción de aminas a partir de derivados halogenados |
Aminas. ¿Dónde se encuentran?
Las aminas se encuentran formando parte de la naturaleza, en los aminoácidos que conforman las proteínas que son un componente esencial del organismo de los seres vivos. Al degradarse las proteínas se descomponen en distintas aminas, como cadaverina y putrescina entre otras. Las cuales emiten olor desagradable. Es por ello que cuando la carne de aves, pescado y res no es preservada mediante refrigeración, los microorganismos que se encuentran en ella degradan las proteínas en aminas y se produce un olor desagradable. Las aminas son parte de los alcaloides que son compuestos complejos que se encuentran en las plantas. Algunos de ellos son la morfina y la nicotina. Algunas aminas son biológicamente importantes como la adrenalina y la noradrenalina.
Las aminas secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco.
Estas aminas pueden reaccionar con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes, originando N-nitrosoaminas secundarias, que son carcinógenas.http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedaes_aminas.htm
Videos http://www.youtube.com/watch?v=nLBHTwHTCFA
AMIDAS
Una amida es un compuesto orgánico que consiste en una amina unida a un ácido carboxílico convirtiéndose en una amina ácida (o amida). Por esto su grupo funcional es del tipo RCONH'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).
Formalmente también se pueden considerar derivados del amoníaco, de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente.Concretamente se pueden sintetizar a partir de un ácido carboxílico y una amina:
IMPORTANCIA Y USOS
Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas, vitaminas.
Es utilizada en el cuerpo para la excreción del amoníaco (NH3).
Muy utilizada en la industria farmacéutica, y en la industria del nailon.
NOMENCLATURA
Las amidas primarias se nombran sustituyendo la terminación oico o ico del nombre sistemático o vulgar, del ácido del que derivan, por el sufijo amida. En las amidas sustituidas se antepone al nombre anterior el de los radicales sobre el nitrógeno, precedidos de la letra N. Ejemplos:
 | ||
| metanamida (formamida) | N-metiletanamida (N-metilacetamida) | N,N-dietilbenzamida |
El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida (p.f.=2,5 ºC), sean todas sólidas y solubles en agua. Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas. Los puntos de fusión y de ebullición de las amidas secundarias son bastante menores, debido principalmente al impedimento estérico del radical unido al nitrógeno para la asociación. Como es natural, las amidas terciarias (sin enlaces N—H) no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y de ebullición de acuerdo con su peso molecular.
Obtención
Las amidas pueden obtenerse a partir de halogenuros de alquilo por reacción con amoniaco, aminas primarias o secundarias, con lo que resultan amidas primarias, secundarias o terciarias, respectivamente. Por ejemplo:
| CH3—CO—Cl + | 2 CH3—NH2 | CH3—CO—NH—CH3 + | CH3—NH3+ | Cl- | |
| cloruro de acetilo | metilamina | N-metilacetamida | cloruro de metilamonio | ||
NITRILOS
| C | Nombre del compuesto | Estructura | PM (g/mol) | P.Fus. (ºC) | P.Eb. (ºC) |
|---|---|---|---|---|---|
| 1 | cianuro de hidrógeno1 | 27,0 | -13,24 | 25,7 | |
| 2 | acetonitrilo o etanonitrilo2 | 41,0 | -45 | 81 | |
| 3 | propionitrilo o propanonitrilo3 | 55,1 | -92 | 97 | |
| 4 | butironitrilo o butanonitrilo4 | 69,1 | -112 | 116-118 | |
| 5 | pentanonitrilo5 | 83,1 | -96 | 139 | |
| 6 | hexanonitrilo6 | 97 | -80 | 161-164 | |
| 7 | heptanonitrilo o caprilonitrilo7 | 111,2 | -64 | 186-187 | |
| 8 | octanonitrilo8 | 125,2 | -45 | 198-200 | |
| 9 | nonanonitrilo o pelargononitrilo9 | 139,2 | -35 | 224 | |
| 10 | decanonitrilo10 | 153,3 | N/D | 241-243 |